C、N、Si、Fe等元素及其化合物有重要的应用。
(1)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(2)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是__________(填写序号)。

(3)继C60之后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是____________(用元素符号表示)。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
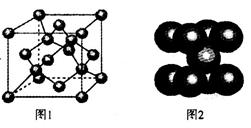
(4)一定条件下,C元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有___________个C原子。
(5)图2为金属铁某种晶体的晶胞结构,已知该晶体的密度为a g/cm3为阿伏加德罗常数的值,则该晶胞的体积为_________cm3.
(8分)(1)Fe或铁(2分) (2)d(1分) (3)N>C>Si(1分) 30(1分)
(4)8(1分) (5)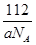 (2分)
(2分)
题目分析:(1)根据构造原理可知,C、N、Si、Fe的核外电子排布分别是1s22s22p2、1s22s22p3、1s22s22p63s23p2、1s22s22p63s23p63d54s2,所以未成对电子数最多的元素是铁。
(2)苯环是平面型结构,则甲苯中碳原子是sp2和sp3杂化;甲烷是烷烃,碳原子是sp3杂化;碳碳双键是平面型结构,则丙烯分子中碳原子是sp2和sp3杂化;碳碳三键是直线型结构,所以1-丁炔分子中碳原子是sp和sp3杂化,答案选d。
(3)非金属性越强,电负性越大,则C、Si、N原子电负性由大到小的顺序是N>C>Si;Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以每个Si原子形成2个单键和1个双键,则双键个数是60÷2=30,又因为双键都是由1个δ键和1个π键构成的,因此Si60分子中π键的数目为30。
(4)根据晶胞的结构并依据均摊法可知,晶胞中含有的碳原子数=8×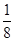 +6×
+6×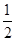 +4=8个。
+4=8个。
(5)铁是体心立方堆积,晶胞中含有的铁原子数=8×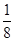 +1=2个,则
+1=2个,则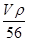 ×NA=2,解得V=
×NA=2,解得V=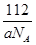 。
。
