已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 。
(2)Y元素原子的电子排布图为 ,元素X与Y的电负性比较:X Y(填“>”或“<”)。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 。
(4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心)

请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为 。
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 。
(1)1s22s22p63s23p63d104s24p3 (其他合理答案也给分) As
(2)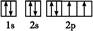 <
<
(3)三角锥形
(4)GaAs (CH3)3Ga+AsH3 GaAs+3CH4
GaAs+3CH4
(5)sp2杂化
X的最外层电子排布为4s24p3,故为33As;2p轨道有两个未成对电子,可能是6C或8O,因Y能够与砷形成As2Y3化合物,故Y为8O;As、O、Z的原子序数之和为42,故Z为1H。
(2)周期表中氧元素在砷元素的右上方位置,故电负性氧大于砷。
(3)AsH3的结构与氨相似,为三角锥形。
(4)As位于晶胞内,有4个。Ga的个数为:8×1/8+6×1/2=4,故化学式为GaAs。
(5)因分子为非极性分子,故空间结构对称,Ga原子处于正三角形的中心,而三个C原子位于三角形的三个顶点上。中心原子Ga为sp2杂化。
