铁及铁的化合物在生产、生活中有着重要的用途。
(1) 已知铁是26号元素,写出Fe的价层电子电子排布式________。已知自然界丰度最大的铁的同位素是中子数为30的铁原子,则该种同位素符号________。
(2) Fe原子或离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物,则与之形成配合物的分子的配位原子应具备的结构特征是________。Fe(CO)3一种配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子。写出CO的一种常见等电子体分子的结构式________;两者相比较,沸点较髙的是________填分子式)。
(3) 1183K以下纯铁晶体的晶胞如图1所示,1183K以上则转变为图2所示晶胞,在两种晶体中最邻近的铁原子间距离相同。
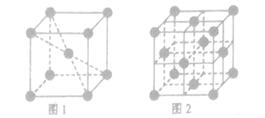
①图1和图2中,铁原子的配位数之比为________。
②空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中占有的体积百分比,则图1和图2中,铁原子的空间利用率之比为________。
(1)3d64s2(2分);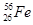 (2分) (2)具有孤电子对(2分);
(2分) (2)具有孤电子对(2分); (2分);CO(2分)
(2分);CO(2分)
(3)2︰3 (2分) ;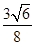 (或0.92︰1)(3分)
(或0.92︰1)(3分)
题目分析:(1)根据构造原理可知,Fe的价层电子电子排布式为3d64s2;在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,所以该微粒的符号是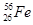 。
。
(2)形成配位健的条件是配体具有孤对电子,中心原子或离子具有空轨道,所以与之形成配合物的分子的配位原子应具备的结构特征是具有孤电子对。原子数和价电子数分别都相等的都是等电子体,所以与CO的一种常见等电子体分子是氮气,其结构式是 。氮气和CO形成的晶体都是分子晶体,其中氮气是非极性分子,CO是极性分子,所以CO的分子间作用力强于氮气的,因此沸点较高的是CO。
。氮气和CO形成的晶体都是分子晶体,其中氮气是非极性分子,CO是极性分子,所以CO的分子间作用力强于氮气的,因此沸点较高的是CO。
(3)①根据晶胞的结构可知,图1中配位数是8,图2中配位数是12,所以配位数之比是2︰3。
②设铁原子半径是r,立方体边长图1是a,图2是b,则根据图1可知a2+2a2=(4r)2,解得a=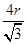 ,所以图1中铁原子的空间利用率是
,所以图1中铁原子的空间利用率是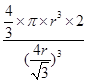 。根据图2可知b2+b2=(4r)2,解得b=
。根据图2可知b2+b2=(4r)2,解得b= ,所以图2中铁原子的空间利用率是
,所以图2中铁原子的空间利用率是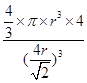 ,所以铁原子的空间利用率之比为
,所以铁原子的空间利用率之比为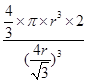 :
: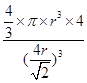 =
=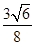 。
。
