A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
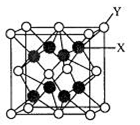
(1)E在同期表中的位置是 ,其基态原子的简化电子排布式为 。
(2)CB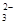 的立体构型是 。
的立体构型是 。
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
(1)第四周期(1分) VIII族(1分); [Ar]3d64s2(2分)
(2)正四面体(2分)
(3)S2-(2分) ;低(2分)
题目分析:根据题目所诉,A基态原子的核外电子占据4个原子轨道,只能为1s22s22p2,A为碳元素。大气平流层中单质B3浓度减少会致人患皮肤癌增加,故B元素为氧元素。D是前四周期元素中第一电离能最小的元素,同周期元素,从左到右,第一电离能逐渐增大,D元素为钾元素。E的合金是当今用量最大的合金,E为铁元素。又因为B、C为同主族元素,C只能为硫元素。(1)E在同期表中的位置是第四周期,VIII族,其基态原子的简化电子排布式为 [Ar]3d64s2。(2)CB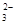 为SO42-,中心原子为S,含有4个σ键,没有孤电子对,硫原子采取sp3,杂化所以其立体构型是正四面体。(3)根据图中所示,晶胞计算后可知,Y:X=2:1,即Y为C,X为D元素。通过题目解析可知,C为硫元素,故Y应为S2-。D2C为K2S,与CaF2都为离子晶体,所以其熔点高低取决于化合物之间的离子键强度,离子键强度高,熔点高。离子键强度的决定因素:①.离子带电荷越大,离子键越强。②.离子半径越小,离子键越强。③.形成离子键两键结原子的电负性差较大者,离子键较强。这里CaF2的电负性差较大,故CaF2融点高。
为SO42-,中心原子为S,含有4个σ键,没有孤电子对,硫原子采取sp3,杂化所以其立体构型是正四面体。(3)根据图中所示,晶胞计算后可知,Y:X=2:1,即Y为C,X为D元素。通过题目解析可知,C为硫元素,故Y应为S2-。D2C为K2S,与CaF2都为离子晶体,所以其熔点高低取决于化合物之间的离子键强度,离子键强度高,熔点高。离子键强度的决定因素:①.离子带电荷越大,离子键越强。②.离子半径越小,离子键越强。③.形成离子键两键结原子的电负性差较大者,离子键较强。这里CaF2的电负性差较大,故CaF2融点高。
