现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
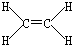
(3) A元素与B、C元素可形成化合物B2A4、C2A4。
①B2A4的结构式为_________。
②下列有关C2A4的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子 d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp3杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。
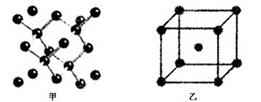
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。
(每空2分,第(4)第1空1分,共计15分)(1)3d64s2(2)B<D<C
(3) ② b、e、f(全对2分,选对1~2个得1分,选错一个均不得分)
② b、e、f(全对2分,选对1~2个得1分,选错一个均不得分)
(4)金刚石;1:2 ;离子的半径与离子所带的电荷
(5)3 :8
:8
题目分析:B元素原子的价层电子总数是内层电子总数的2倍,所以B是碳元素。D元素原子的L电子层中只有两对成对电子,因此D是氧元素。C的原子序数介于B和D中间,则C是氮元素。E元素的基态原子有4个未成对电子,这说明E应该是第四周期元素,可能是Cr或Fe。E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,所以E只能是Fe,F是Cu。
(1)铁的原子序数是26,根据构造原理可知,其价电子排布式为3d64s2。
(2)B为碳元素,C为氮元素,D为氧元素,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N。
(3)A元素与B、C元素可形成化合物B2A4、C2A4,这说明A应该是氢元素。
①B2A4是乙烯,其的结构式为 。
。
②C2A4的结构式是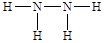 ,所以a. 一个该分子中含有5个σ键,a不正确;b.该分子中氮元素含有孤对电子,所以可作为配位体形成配位键,b周期;c.该分子不对称,是极性分子,c不正确;d.由于氮元素可以形成氢键,所以平均1个N2H4分子可以形成6÷2=3个氢键,因此1mol该分子最多可形成3mol氢键,d不正确;e.氢键不是化学键,不影响物质的稳定性,即该分子的稳定性与氢键无关,e正确;f.该分子中N原子的原子轨道是sp3杂化,f正确,答案选bef。
,所以a. 一个该分子中含有5个σ键,a不正确;b.该分子中氮元素含有孤对电子,所以可作为配位体形成配位键,b周期;c.该分子不对称,是极性分子,c不正确;d.由于氮元素可以形成氢键,所以平均1个N2H4分子可以形成6÷2=3个氢键,因此1mol该分子最多可形成3mol氢键,d不正确;e.氢键不是化学键,不影响物质的稳定性,即该分子的稳定性与氢键无关,e正确;f.该分子中N原子的原子轨道是sp3杂化,f正确,答案选bef。
(4)根据晶胞的几个可知,甲是金刚石。根据晶胞结构可知,金刚石中配位数是4,而铁是体心立方堆积,配位数是8,所以甲中B原子的配位数与图乙中E原子的配位数之1:2;E元素与D元素形成的ED晶体与NaCl晶体一样,都是离子晶体,所以欲比较ED与NaCl的晶格能大小,应该比较晶格能大小,即需要考虑的数据是离子的半径与离子所带的电荷。
(5)体心立方晶胞中铜原子个数=1+8×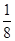 =2;面心立方晶胞中实际含有的铜原子个数=6×
=2;面心立方晶胞中实际含有的铜原子个数=6×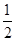 +8×
+8×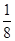 =4。设铜原子半径是a,六方紧密堆积和面心立方堆积的边长分别为x和y,则x2+2x2=(4a)2、y2+y2=(4a)2,解得x=
=4。设铜原子半径是a,六方紧密堆积和面心立方堆积的边长分别为x和y,则x2+2x2=(4a)2、y2+y2=(4a)2,解得x=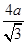 、y=
、y=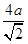 ,所以根据
,所以根据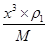 ×NA=2、
×NA=2、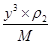 ×NA=4可知,二者的密度之比ρ1:ρ2=3
×NA=4可知,二者的密度之比ρ1:ρ2=3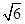 :8。
:8。
