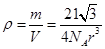已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26。
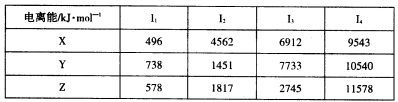
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
回答下列问题:
(1)B元素原子核外已成对电子数是未成对电子数的____倍。
(2)X、Y、Z的电负性从大到小的顺序为____(用元素符号表示)。
(3)分子式为A2B、A2E的两种物质中 __更稳定(用化学式表示),原因是____。
(4)X的氯化物的熔点比Y的氯化物的熔点____,原因是____。
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为____。等电子体指的是原子总数相同.价电子总数相同的分子.离子或基团,据此定义写出离子SCN—的一种等电子体____。
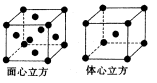
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为- 20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)5的晶体类型为 。F元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如
图所示。在面心立方晶胞中F原子的配位数为____,体心立方晶胞的密度可表示为____。(F的原子半径为r)

题目分析:依题意可知:A为H,B为O,E为S,F为Fe,X的第一电离能小容易失去一个电子,所以为Na,Y的第三电离能突然增大,表明Y为Mg,同事Z为Al。
(6)小题中的物质溶沸点低,易溶于有机溶剂,所以为分子晶体。
由分摊法计算: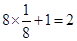 ;该晶胞的质量m=
;该晶胞的质量m=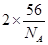 ,设该晶胞的边长为a:则有:
,设该晶胞的边长为a:则有:
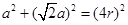 解之得:
解之得: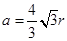
该晶胞的体积:
晶胞的密度为: