已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 .
(4)E的最高价氧化物分子的空间构型是 。其中心原子的杂化方式为 。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为 。
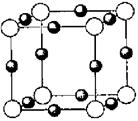
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑 * * 表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
(1)3s23p63d10(2分)
(2)Na<Al<Si(2分)
(3)氨分子与水分子之间存在氢键(2分)
(4)平面正三角形(2分) sp2(1分)
(5) 4(2分)
(6)Cu3N (2分) 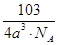 (2分)(其它合理答案也给分)
(2分)(其它合理答案也给分)
题目分析:原子核外有三个未成对电子,其电子排布式为1S22S22P3,为N元素,E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p3,应为S元素,C元素是地壳中含量最高的金属元素,为Al元素,化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,应为Na元素,D单质的熔点在同周期元素形成的单质中是最高的,应为Si元素,单质硅为原子晶体,熔点在第三周期中最高,F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物,应为Cu元素.
(1)Cu的原子的电子排布式为1s22s22P63s23p63d104s1,M层电子排布式为3s23p63d10
(2)在元素周期表中,同一周期元素的第一电离能从左到右逐渐增大,同一主族元素的第一电离能从上到下逐渐减小,据此可判断三种元素的第一电离能的顺序为:Na<Al<Si
(3)A(N)的简单氢化物分子是氨气,氨气极易溶于水,其主要原因N、O的电负性强,分子之间形成氢键;
(4)S03中含有3个δ键,孤电子对数为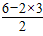 =0,所以分子的空间构型是平面正三角形,sp2杂化
=0,所以分子的空间构型是平面正三角形,sp2杂化
(5)铜离子与氨气可以配位键形成配合物,其化学式为,[Cu(NH3)4]2+
(6)根据晶胞中微粒个数的分配方法计算,晶胞中含有原子的数目为8×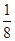 =1,原子的数目为:12×
=1,原子的数目为:12×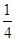 =3,故化学式为Cu3N,白球与黑球之间的距离为a cm,边长为2acm,则
=3,故化学式为Cu3N,白球与黑球之间的距离为a cm,边长为2acm,则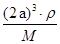 ×NA=1,解得ρ=
×NA=1,解得ρ=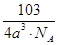 。
。
