已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
| 元素 | 性质或结构信息 |
| A | 单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。 |
| B | 原子的M层有1个未成对的p电子。核外p电子总数大于7。 |
| C | 单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。 |
| D | 原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。 |
| E | 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。 |
| F | 周期表中电负性最大的元素 |
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
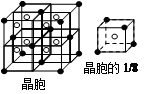
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。
(1)3s23p4(2分),14(1分)。(2)N,F (各1分,共2分)
20090116 |
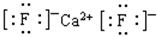 (2分)
(2分) 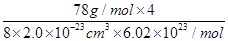 =3.2 g/cm3(列式2分,结果1分,无单位扣1分)
=3.2 g/cm3(列式2分,结果1分,无单位扣1分)题目分析:A、单质常温下为固体,难溶于水易于溶CS2,能形成2种二元含氧酸,因此A是S;B、原子的M层有1个未成对的p电子,核外p电子总数大于7,则B应该是Cl;C、单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,单质能溶强酸和强碱,所以C是Al;D、原子核外电子层上s电子总数比p电子总数少2个,单质和氧化物均为空间网状晶体,具有很高的熔、沸点,则D是Si;E、其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高,则E是N;F、周期表中电负性最大的元素是F,即F是氟元素。
(1)S元素位于第三周期第ⅥA族,所以S原子的最外层电子排布式为3s23p4;Si元素的原子序数是14,核外电子数是14个,所以Si原子共有14种不同运动状态的电子。
(2)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,其第一电离能大于氟元素的,所以F与E元素第一电离能的大小关系:N>F。
(3)非金属性是S弱于Cl,所以两种元素的氢化物分子中键能较小的是H2S;非金属性越强,氢化物的稳定性越强,因此分子较稳定的是HCl。
(4)原电池中较活泼的金属做负极,镁的金属性强于Al。但由于铝能和氢氧化钠溶液,二镁不能,所以单质铝、镁、NaOH溶液构成的原电池中铝是负极,镁是正极,因此负极的电极反应式为Al-3e-+4OH- =AlO2-+2H2O。
(5)根据晶胞的结构图并依据均摊原理可知,氟原子的个数=8个,钙原子的个数=8×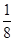 +6×
+6×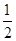 =4个,因此该化合物的化学式为CaF2,含有离子键的离子化合物,因此其电子式为
=4个,因此该化合物的化学式为CaF2,含有离子键的离子化合物,因此其电子式为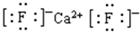 ;已知该化合物晶胞1/8的体积为2.0×10-23cm3,则该晶胞的体积是8×2.0×10-23cm3,因此根据晶胞中钙离子的个数是4个可知
;已知该化合物晶胞1/8的体积为2.0×10-23cm3,则该晶胞的体积是8×2.0×10-23cm3,因此根据晶胞中钙离子的个数是4个可知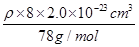 ×6.02×1023/mol=4,解得ρ=
×6.02×1023/mol=4,解得ρ=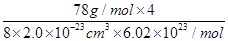 =3.2 g/cm3。
=3.2 g/cm3。
