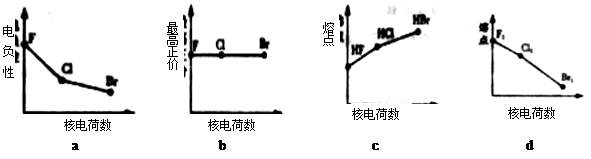
(1)下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是____________。
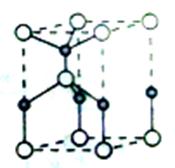
(2)利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为___________。
(3)BCl3和NCl3中心原子的杂化方式分别为________和_________。第一电离能介于B、N之间的第二周期元素有________种。
(4)若BCl3与XYm通过B原子与X原子间的配位健结合形成配合物,则该配合物中提供孤对电子的原子是________。
(5)SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。
长石是金属铝硅盐。由钠长石化学式NaAlSi3O8可推知钙长石改写成氧化物的形式可表示为
(1)a (2)2;BN (3)sp2;sp3 ;3(4)X (5)CaO.Al2O3.6SiO2
题目分析:(1)随着核电荷数的增加,卤素元素得电子能力减弱,电负性逐渐减弱;a正确,氟元素没有正价,b错误,对应氢化物HF分子间有氢键存在,熔点最高,c错误,单质的熔点,取决于分子间作用力,结构相似,相对分子质量越大,分子间作用力越强,熔点越高,d错误。(2)利用“卤化硼法”合成含B和N两种元素的功能陶瓷,B和N两种元素在同一周期,原子半径逐渐减小,B大于N,因此白球是B,黑球是N,根据晶胞图,B在8个顶点和体心一个,因此8个顶点分摊后8乘八分之一,只有一个,加上体心一个共有2个,N在棱上有4个和体心一个,棱上4个分摊后4乘四分之一,只有一个,加上体心一个共有2个,所以化学式BN,(3)BCl中的B原子的杂化方式类似BF3属于sp2杂化;NCl3中的N原子的杂化方式类似NH3属于sp3杂化。根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能属于特殊情况,要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素。(4) BCl3是缺电子化合物,B原子的所有价电子已经使用,因而提供孤对电子的原子是X。(5)由钠长石化学式NaAlSi3O8可推知钙长石化学式CaAlSi6O16改写成氧化物的形式可表示为CaO.Al2O3.6SiO2
