X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关回答均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_______。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________。
(3)X与Z中电负性较大的是__________;Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是_____,此离子中含有的化学键类型是____;X一Z一X的键角_____109. 50。(填“>”、“=”或“<”)
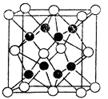
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以相距一个X离子最近的所有Y离子为顶点构成的几何体为 。该化合物与MgO相比,熔点较高的是_____。
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为____g/cm3。(列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
(1)1s22s22p63s23p63d54s1或者[Ar]3d54s1
(2)HF分子间存在氢键,而HCl分子间不存在氢键
(3)O 三角锥形 共价键(答极性键或配位键均可) <
(4)8 立方体或正方体 MgO
(5)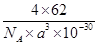
题目分析:(1)依据洪特规则可推知前四周期中基态原子中单电子数最多也即价层电子排布式为3d54s1(单电子数为6),则R为铬元素,其基态原子核外电子排布式为1s22s22p63s23p63d54s1或者[Ar]3d54s1。
(2)结合题干信息可推知元素X、Y、Z、W分别为O、Na、Cl、Mn;因HF分子间存在氢键,而HCl分子间不存在氢键,故沸点:HF>HCl。
(3)O与Cl中电负性较大的是O;Cl的含氧酸盐中用于实验室制取氧气的盐为KClO3,ClO的价层电子对数为4(3个σ键、1对孤电子),故ClO的空间构型(VSEPR模型为四面体)同NH3一样为三角锥形;ClO3中Cl、O间为共价键,由于中心原子上存在一对孤电子,孤电子对的排斥力大于成键共用电子对;故O—Cl—O的键角小于109°28′。
(4)由晶胞结构可知O2-(晶胞中空心球)的配位数为8;与一个O2-距离最近的Na+为顶点形成的几何体为立方体;由于Mg2+所带电荷比Na+多,且离子半径小于Na+的离子半径,因此MgO的晶格能大于Na2O的,则熔点:MgO>Na2O。
