叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是________,第一电离能最小的元素是_______。
(2)基态氮原子的L层电子排布图为_______________。
(3)与N3-互为等电子体的分子为__________(写出一种)。依据价层电子对互斥理论,NO3-的空间构型为_____________。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为_________________。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:_____________________________。
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是__________________。
(6)安全气囊的设计原理为6NaN3+Fe2O3  3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①氮分子中σ键和π键数目之比为________________________。
②铁晶体中存在的化学键类型为__________________________。
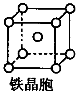
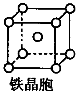
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为___________(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。
(1)氟(或F)(1分) 锂(或Li)(1分)
(2)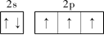 (2分)
(2分)
(3)CO2或N2O(1分) 平面三角形(1分)
(4)离子晶体(1分) N3+H2O HN3+OH(2分)
HN3+OH(2分)
(5)氨分子之间存在氢键(N2O分子间只存在范德华力,氢键作用较强)(2分)
(6)1∶2(1分) 金属键(1分) 112/NA·a3 g·cm-3(2分)
题目分析:(1)根据同周期元素性质递变规律判断,氮所在的周期中,电负性最大的元素是氟,第一电离能最小的元素是锂;(2)基态氮原子的核外电子排布式为1s22s22p3,L层电子排布图为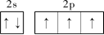 ;(3)根据等电子体的概念判断,与N3-互为等电子体的分子为CO2或N2O;依据价层电子对互斥理论,NO3-的中心原子有三对价电子,空间构型为平面三角形;(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为离子晶体;叠氮化钠为强碱弱酸盐,其中叠氮酸根水解,水溶液呈碱性,用离子方程式表示其原因:N3—+H2O
;(3)根据等电子体的概念判断,与N3-互为等电子体的分子为CO2或N2O;依据价层电子对互斥理论,NO3-的中心原子有三对价电子,空间构型为平面三角形;(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为离子晶体;叠氮化钠为强碱弱酸盐,其中叠氮酸根水解,水溶液呈碱性,用离子方程式表示其原因:N3—+H2O HN3+OH—;(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是氨分子之间存在氢键(N2O分子间只存在范德华力,氢键作用较强);(6)①氮分子中含有氮氮三键,含有1个σ键和和2个π键,数目之比为1∶2;②铁晶体为金属晶体,存在的化学键类型为金属键;③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为___________(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。缺少晶胞结构无法进行解析!
HN3+OH—;(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是氨分子之间存在氢键(N2O分子间只存在范德华力,氢键作用较强);(6)①氮分子中含有氮氮三键,含有1个σ键和和2个π键,数目之比为1∶2;②铁晶体为金属晶体,存在的化学键类型为金属键;③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为___________(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。缺少晶胞结构无法进行解析!
