已知短周期的主族元素X、Y、Z、W、M的原子序数依次增大,X是空气中含量最
多的元素,其单质的化学性质非常稳定,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W元素形成的单质为淡黄色的固体,M元素形成的单质为黄绿色气体.请回答以下问题:
(1)X元素的符号是 ,它在周期表的位置为 ;
(2)Z的氧化物晶体类型为 ,化学式是: ;
(3)X与Y能形成离子化合物,该化合物的电子式为 ;
(4)X的最高价氧化物的水化物与Y的氧化物反应的化学方程式为 ;
(5)X、W形成的氢化物分别为甲和乙,且甲、乙所含的电子数相等,则甲的结构式为 ;
(6)W和M都是较活泼的非金属元素,用实验事实表明这两种元素的非金属性强弱(用方程式书写或文字说明) 。
(1)N,第二周期第ⅤA族(2)原子晶体 ,SiO2
(3)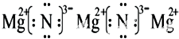
(4)2HNO3+MgO=Mg(NO3)2+2H2O
(5)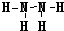
(6)Cl2+H2S=2HCl+S,
题目分析:X是空气中含量最多的元素,X为氮元素;Z单质可制成半导体材料,Z为硅元素;则Y是镁元素;W元素形成的单质为淡黄色的固体,M元素形成的单质为黄绿色气体,则W、M为硫、氯。
(1)X元素符号是N,是第三周期第ⅤA族元素;
(2)Z的氧化物是SiO2,属于原子晶体;
(3)X与Y形成的离子化合物为Mg3N2电子式为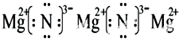
(4)X的最高价氧化物的水化物是HNO3,Y的氧化物是MgO,二者反应的化学方程式为2HNO3+MgO=Mg(NO3)2+2H20;
(5)X、W形成的氢化物分别为甲和乙,且甲、乙所含的电子数相等,甲为N2H4,乙为H2S, N2H4的结构式为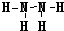 ;
;
(6)S的非金属性比Cl的弱,可用Cl2和H2S反应置换S。
