(2013山东临沂一模)(15分)碳是形成化合物种类最多的元素。
(1)CH2 CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。
CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。
(2)乙醇(CH3CH2OH)与二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是 。
(3)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为 。
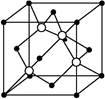
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能,右图所示的碳化硅的晶胞(其中 为碳原子,
为碳原子, 为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
(1)3∶1(2分) sp3、sp(2分)
(2)乙醇中分子间能形成氢键,甲醚不能形成氢键,导致乙醇的沸点高于甲醚(3分)
(3)3d84s2(2分) (4)4(2分) NA=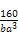 /mol (4分)
/mol (4分)
(1)单键是σ键,双键中一个是σ键,一个是π键,三键中一个是σ键,两个是π键,所以σ键和π键的个数之比为6∶3=2∶1,从左边开始判断,第一、二个碳原子都含有三个σ键,采取sp2杂化,第三个碳原子含有两个σ键,采取sp杂化。
(2)乙醇中分子间能形成氢键,甲醚不能形成氢键,导致乙醇的沸点高于甲醚。
(3)基态碳原子的未成对电子数是2,位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同的元素是Ni元素,其基态原子的价层电子排布式为3d84s2。
(4)根据图像知,每个碳原子周围有四个硅原子;该晶胞中含有的碳原子个数=8× +6×
+6× =4,硅原子个数=4,密度为b g/cm3=
=4,硅原子个数=4,密度为b g/cm3=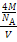 =
=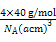 ,NA=
,NA=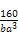 /mol。
/mol。
