A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B ,G 。
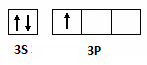
(2)写出F的价电子排布图: 。
(3)写出化合物BC的结构式: 。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是 。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是 。
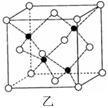
(6)E的一种晶体结构如图甲,则其一个晶胞中含有 个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为 pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)
(1)碳,铜。(各2分,共4分。若写元素符号1个给1分。)
(2) (1分,其它的合理形式也可)
(1分,其它的合理形式也可)
(3)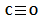 (2分)
(2分)
(4)sp3杂化。(2分)
(5)HF分子间通过氢键形成缔合分子(2分)
(6)2(2分); (2分)
(2分)
题目分析:(1)A与其他元素既不同周期又不同族,A是氢;B、C的价电子层中未成对电子数都是2,B是碳,C是氧;E核外的s、p能级的电子总数相等,E是镁;F与E同周期且第一电离能比E小,F是铝;G的+1价离子(G+)的各层电子全充满,G是铜。A~G是前四周期除稀有气体之外原子序数依次增大的七种元素,所以D是氟。
(2)F是铝原子,所以价电子排布图 。
。
(3)C原子与O使用2个共用电子对形成2个正常的共价键,然后O原子拿出1对电子与C形成1个配位键,所以C与O是三个共价键。所以化合物CO的结构式: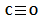 。
。
(4)[Al(OH)4]中Al的杂化类型sp3杂化,正四面体。
(5)F元素电负性很大,分子之间形成氢键,以形成缔合分子(HF)n,实验测得HF的相对分子质量一般高于理论值,
(6)晶体镁的晶胞是平行六面体,也就是六棱柱的三分之一,所以一个晶胞中含有8×1/8+1=2(2分);
CuF晶胞结构知含有4个CuF,设立方体的边长为r,V=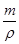 =
=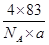 =r3,解得立方体的边长为r=
=r3,解得立方体的边长为r=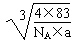 cm
cm
Cu与F的最近的距离是○与●连线,根据数学知识解的Cu与F的最近的距离是
 。
。

