【物质结构与性质】
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。
(1)M原子的外围电子排布式为__________,在周期表中属于 区元素。
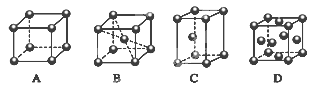
(2)M的堆积方式属于钾型,其晶胞示意图为______(填序号)。
(3)MCl3·6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3 B、[M(H2O)5Cl]Cl2·H2O和C、[M(H2O)4Cl2]Cl·2H2O。为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为 (填A或B或C)。
(4)MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态MO2Cl2属于________晶体;
②CS2中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为____杂化和________杂化。
(5)+3价M的配合物K[M(C2O4)2(H2O)2]中,配体是______,与C2O42-互为等电子体的分子是(填化学式)__________。
(1)3d54s1 d
(2)B
(3)B
(4)①分子 ②sp、sp2
(5)C2O42-、H2O;N2O4
(1)M原子的最外层有空轨道,且有两个能级处于电子半充满状态,说明M为Cr,Cr原子的外围电子排布式为3d54s1;在元素周期表位于d区。
(2)Cr的堆积方式属于钾型,K为体心立方堆积,故B型正确。
(3)取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g,沉淀为AgCl,所以Cl‾的物质的量为2.870g÷143.5g/mol=0.2mol,说明1mol该物质含有2mol Cl‾,故B项正确。
(4)①MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,熔沸点较低,所以固态MO2Cl2属于分子晶体。
②CS2的结构类似于CO2,所以CS2中碳原子的杂化方式为sp杂化;丙酮(CH3COCH3)羰基中的碳原��形成了3个σ键,无孤对电子,所以为sp2杂化。
(5)根据配合物K[M(C2O4)2(H2O)2]可知配体为:C2O42-、H2O;C2O42-含有46个电子,所以与N2O4互为等电子体。
