由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题。
(1)该配位化合物X的化学式为 。
(2)元素B、C、D的第一电离能的由小到大排列顺序为 。(用元素符号表示)
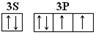
(3)D元素原子的最外层电子轨道表示式为________ 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
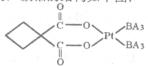
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如下图:其中碳原子的杂化方式有____ 。碳铂中含有的作用力有 (填字母)。
A.共价键
B.配位键
C.金属键
D.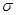 键
键
E.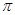 键
键
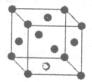
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p= g/cm3。
(1)(1)Cu(NH3)4SO4×H2O (2分)
(2)S<O<N (1分)
(3) (1分)
(1分)
(4)H2O与H2O2之间形成氢键(2分)
(5)sp3和sp2(2分)ABDE(2分)
(6)6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O(3分); 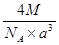 (2分)
(2分)
题目分析:(1)由题意可推知A为H元素,B为N元素,C为O元素,D为S元素,E元素的外围电子排布为(n-l)dn+6ns1,E为Cu元素,该配位化合物X的化学式为Cu(NH3)4SO4×H2O
(2)N、O、S三种元素中,N的2p轨道是半充满状态,所以第一电离能最大,O、S同主族,同主族元素的第一电离能从上到下逐渐减小,所以N、O、S三种元素的第一电离能从小到大的排列顺序是S<O<N
(3)D为S元素,最外层电子是6个电子,电子排布式是3s23p6,轨道表示式为
(4)H、O元素可形成化合物H2O与H2O2,二者之间能互溶是因为H2O与H2O2之间形成氢键
(5)C原子周围形成4个共价单键为sp3杂化,形成2个共价单键和1个双键是sp2杂化;碳铂中单键为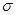 键,双键中有1个为
键,双键中有1个为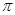 键,且Pt与N原子间形成配位键,所以碳铂中含有的作用力有共价键、配位键、
键,且Pt与N原子间形成配位键,所以碳铂中含有的作用力有共价键、配位键、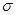 键、
键、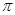 键,答案选ABDE;
键,答案选ABDE;
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,则Y为CuH,与稀硝酸反应得蓝色溶液为硝酸铜溶液,两种气体为氢气、一氧化氮,所以该反应的化学方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;该晶胞中实际含4个Cu,其质量为4×M/NA,晶胞体积为a3cm3,所以该晶胞密度的计算式为ρ=4×M/NA/ a3= 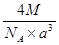 g/cm3
g/cm3