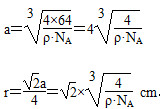现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(1)A的基态原子最外层有______种不同运动状态的电子。
(2)E2+的基态核外电子排布式为____________________。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是________。A、B、C三种元素组成的分子中与AC2互为等电子体的分子为________________(用元素符号表示)。
(4)BD3中心原子的杂化方式为________,其分子空间构型为____________。
(5)用晶体的X射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如下图),又知该晶体的密度为ρ g·cm-3,晶胞中该原子的配位数为______________;F的原子半径是________ cm(阿伏加德罗常数为NA)。
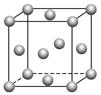
(1)4
(2)1s22s22p63s23p63d5或[Ar]3d5
(3)CH4<NH3<H2O N2O
(4)sp3 三角锥形
(5)12 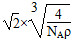
A的电子排布式为1s22s22p2,为C元素;B的电子排布式为1s22s22p3,为N元素;C的电子排布式为1s22s22p4,为O元素;D为Cl元素,E为Mn元素,F为Cu元素。
(1)有几个电子就有几种运动状态,所以C元素的最外层应有4种不同运动状态的电子。
(3)对于CH4、NH3、H2O,由于H2O、NH3均存在分子间氢键,所以熔点H2O>NH3>CH4,在C、N、O组成的分子中与CO2互为等电子体的分子为N2O。
(4)NCl3中N原子采取sp3杂化,其分子空间构型为三角锥形。
(5)铜原子半径为面对角线的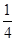 ,设棱长为a,
,设棱长为a,
则a3·ρ·NA=4×64