I.S4N4的结构如图:

(1)S4N4的晶体类型是___。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4,化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是___;
a离子键;b极性键;c非极性键;d金属键;e配位键;f范德华力
②S2Cl2中,S原子轨道的杂化类型是___。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
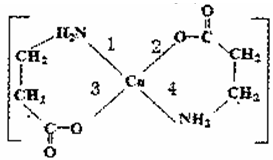
(3)基态Cu2+的外围电子排布式为_ _。
(4)二甘氨酸合铜( II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是 _。
(5)lmol二甘氨酸合铜(II)含有的二键数目是 _ 。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是 ____ (填写编号)。
(1)分子晶体(1分)
(2)① d (2分)②sp3 (2分)
(3)3d9 (2分)
(4)正四面体形(2分)
(5)2NA或1.204×1024 (2分)
(6)1和4 (2分)
题目分析:(1))S和N均是活泼的非金属,则S4N4的结构式可知,结构中存在分子,因此形成的晶体类型是分子晶体。
(2)①在反应6S2Cl2+16NH3=S4N4+S8+12NH4Cl过程中,反应物中的化学键有极性键和非极性键,且二者形成的晶体都是分子晶体,且氨气中存在氢键。而反应后又有共价键和离子键形成,氯化铵是离子化合物,存在配位键,所以没有破坏或形成的微粒间作用力是金属键,答案选d。
②S2Cl2结构式为Cl-S-S-Cl,其中每个S原子形成2个共价键,同时还含有2对孤对电子,即S原子价层电子对数是4,所以S原子轨道的杂化类型是sp3杂化。
(3)铜元素的原子序数是29,则根据核外电子排布规律可知铜元素的核外电子排布式为1s22s22p63s23p63d104s1,则基态Cu2+的外围电子排布式为3d9。
(4)由于氮元素的2p广东电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,所以二甘氨酸合铜( II)中,第一电离能最大的元素是氮元素,电负性最小的非金属元素是氢元素。二者形成多种微粒,其中一种是5核10电子的微粒,该微粒是NH4+,微粒中氮元素价层电子对数是4,且不存在孤对电子,所以空间构型是正四面体形。
(5)根据结构式可知,分子中存在2个碳氧双键,所以lmol二甘氨酸合铜(II)含有的二键数目是2NA或1.204×1024。
(6)由于氢氧化铜能溶解在氨水中形成配位键,这说明铜更容易与氮元素形成配位键,所以二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是1和4。
