【化学—物质结构与性质】(15分)
许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列有关问题:
(1)基态Ni核外电子排布式为________________, 第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________________;
(2)①已知CrO5中Cr为+6价,则CrO5的结构式为 。
②金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体
互为等电子体的离子的化学式为 (写出一个即可)。
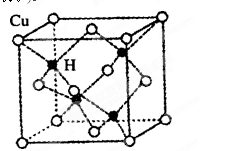
③铜是第四周期最重要的过渡元素之一,其单质及化合物有广泛用途。已知CuH晶
体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则
该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。
(3)另一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为__________,若该晶胞的边长为a pm,则合金的密度为_________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
(15分)(1)1s22s22p63s23p6 3d84s2 (2分) C(碳)(2分)
(2) ①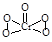 (2分) ② CN-(C22- 、O22+)(2分)
(2分) ② CN-(C22- 、O22+)(2分)
③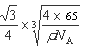 (2分)
(2分)
(3) 1∶3(2分) (197+64×3) ×1030/(a3NA)(3分)
题目分析:(1)基态Ni是28号元素,改进核外电子的排布原理,其核外电子排布式为1s22s22p63s23p6 3d84s2;Ni原子中有2个未成对电子,第二周期中有2个未成对电子的是C或O,其中电负性最小的是C;
(2)①已知CrO5中Cr为+6价,Cr原子周围5个O原子,说明Cr与1个O原子是双键结合其余为单键,O原子成2个共价键,所以CrO5结构式为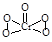 ;
;
②Ni(CO)n中配体是CO,是2原子10个价电子的分子,与它是等电子体的离子有CN-(C22- 、O22+);
③ CuH晶胞中有4个Cu原子和4个H原子,设晶胞棱长为acm,则4×65/NA/a3=ρg/cm3,则a3=4×65/ρ NA该晶胞中Cu原子与H原子之间的最短距离为以4个Cu原子为顶点H原子为中心的正四面体的中心到顶点的距离,正四面体的棱长为面对角线的一半即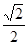 a,利用数学知识可求正四面体的中心到顶点的距离为
a,利用数学知识可求正四面体的中心到顶点的距离为 ×
×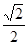 a=
a=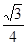 a=
a=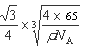 ;
;
(3)位于顶点的原子是该晶胞的1/8,所以顶点上的Au原子的个数是8×1/8=1,位于面心的原子属于该晶胞的1/2,所以Cu原子的个数为6×1/2=3,则该合金中Au原子与Cu原子个数之比为1:3;1pm=1×10-10cm,所以该合金的密度是(197+3×64)/ NA/(a×10-10)3=(197+64×3) ×1030/(a3NA)。
