已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
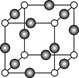
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
⑴N>O>C ⑵[Ar] 3d9 ⑶C2H6氮的氢化物(N2H4)分子间存在氢键
⑷sp2 4NA ⑸Cu3N 6
题目分析:根据题意可知这几种元素分别是:X是H;Y是C;Z是N;W是O;K是Cu。⑴一般情况下,同一周期的元素,元素的非金属性越强,其失去电子越难,即第一电离能就越大。但是由于N原子的电子处于半充满的稳定状态,所以失去电子比O还难,因此C、N、O元素的第一电离能由大到小的顺序是N>O>C。⑵29号元素Cu的二价离子电子排布式是[Ar] 3d9。(3)具有18个电子的碳元素的氢化物的化学物质为C2H6。具有18个电子的氮元素的氢化物的化学物质为N2H4。C2H6、N2H4的沸点相差较大是因为在乙烷C2H6的分子间只有分子间作用力,而在联氨N2H4的分子间除了有分子间作用力外,还存在氢键。增加了分子之间的相互作用。⑷若H、O、C形成的某化合物呈酸性,相对分子质量为46的物质为甲酸HCOOH。该化合物分子中Y原子轨道的杂化类型sp2杂化。在1 mol该分子中含有 σ键的数目是4NA。⑸在该晶胞中含有的N原子个数为:8×1/8="1;" 含有的Cu原子个数为:12×1/4=3.所以该晶体的化学式为Cu3N。在晶体中与N原子距离相等且最近的Cu原子个数为6,它们分别在N原子的上、下、前、后、左、右六个方向。因此N原子的配位数是6。