现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序 。
(2)下列说法错误的是 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物 (高或低),原因是 。
(4)B单质的一种同素异形体的晶胞如图甲所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为 cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
① F原子的外围电子排布式为________。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为 。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图乙所示的离子:该离子中碳原子的杂化方式有 。

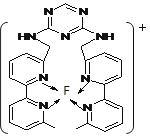
图甲 图乙
(1)C<O<N(2分)
(2)ACD(2分)
(3)低(1分) Fe2+半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小(2分)
(4)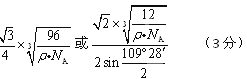
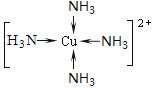
(5)①3d104s1 (1分) (2分)
②sp2、sp3(2分)
题目分析:B元素含有3个能级1s、2s、2p,且每个能级所含的电子数相同,都是2个电子,则B为C元素;D的原子核外有8个运动状态不同的电子,所以D是O元素;则C是N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,说明E、F是第四周期元素,因为前三周期相邻主族元素的原子序数只差1,E元素的基态原子有4个未成对电子,则E为26号元素Fe,F为29号元素Cu。
(1)同周期元素第一电离能随核电荷数增大而升高,但N的2p轨道电子是半充满,比较稳定,不易失去,所以C、N、O三种元素的第一电离能由低到高的顺序是C<O<N;
(2)A、二氧化硅是原子晶体,二氧化碳是分子晶体,所以沸点:SiO2>CO2,A错误;B、同周期元素随核电荷数增大而增强,正确;C、N2与CO为等电子体,具有相似的化学结构,错误;D、氢键与熔沸点高低有关,因为O的原子半径小于S的原子半径,所以H2O分子中共价键比H2S强,所以水更稳定,错误,答案选ACD;
(3)FeO的沸点比Fe2O3低,是因为Fe2+半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小的缘故;
(4)该晶胞中有8×1/8+6×1/2+4=8个C原子,设晶胞的棱长是acm,则ρ="8×12" NA/a3, 晶体中最近的两个原子是以面对角线一半的两端的C原子构成的正四面体中心与顶点的距离,利用数学知识课求解,答案为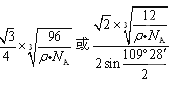 。
。
(5)①F为29号Cu,外围电子的排布式为3d104s1,N为氨气,向硫酸铜溶液中通入过量氨气,生成四氨合铜络离子,其结构式为

②C与N(或C)以不饱和键结合时是sp2杂化,以饱和键结合时为sp3杂化。
