问题
填空题
【物质结构与性质】
天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。
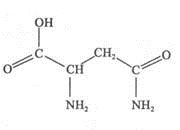
(1)天冬酰胺所含元素中 (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见下表。
| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3o | 一60.75 |
| H2Se | 1.47 | 91.0o | 一41.50 |
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
| 编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
答案
(1)氮 2
(2)①分子晶体 极性键
②由于S的电负性强于Se,形成的共用电子对斥力大,键角大
(3)Mn 3d54s1
(1)根据天冬酰胺结构可判断所含元素为C、H、N、O,价电子排布式分别为:2s22p2、1s1、2s22p3、2s22p4,未成对电子分别为:2、1、3、2,故氮元素未成对电子最多;从结构中看碳原子形成的化学键的类型有单键和双键,碳原子中碳以sp3和sp2杂化。
(2)①从表中数据看,H2Se沸点很低,故为分子晶体;H2Se中H和Se是不同的非金属原子,故形成的为极性共价键。
②从数据看,由于H-S键键长比H-Se键长短,两氢原子距离更近,斥力更强,因而H2S的键角更大(或由于S的电负性比Se大,使共用电子对间的排斥力变大,因而H2S的键角更大。
(3)钼和铬在同一副族,性质存在相似性和递变性,故电离能也存在相似性,B、C电离能变化相似,且铬的金属性小于钼,故铬的电离能比钼的相应要大,故B为铬,C为钼,A代表锰元素,元素符号为Mn,铬的价电子排布为3d54s1。
