金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C B(选填“>”“<”),第一电离能N>O,原因是 。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为 ,其中硫原子采用 杂化,氧原子的价电子排布图为 ,任意写出一种SO42-等电子体 。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
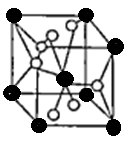
则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
(1)1s22s22p63s23p63d24s2
(2)> N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O
(3)正四面体;sp3 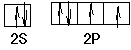 CCl4或ClO4-或S2O32-或PO43-
CCl4或ClO4-或S2O32-或PO43-
(4)TiO2
(1)Ti是22元素,核外电子排布式是1s22s22p63s23p63d24s2
(2)非金属性越强,电负性越大,所以电负性C大于B;N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O;
(3)SO42-是AB4型,原子的孤对电子对数是(6+2-4×2)/2=0,所以立体构型是正四面体,采取sp3杂化;氧原子价电子是6,其价电子排布图是, ,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
(4)O的个数是4×1/2+2=4,Ti的个数是8×1/8+1=2,该晶体的化学式为TiO2。
