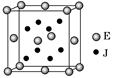
已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大。A与另外四种元素既不在同一周期,也不在同一主族。J和D同主族,E和G同周期;元素G是周期表中的第7列元素,E的最外层电子数与最内层电子数相同,E跟J可形成离子化合物,其晶胞结构(其中J原子在晶胞内部)如图。
请回答下列问题:
(1)D元素-1价离子的电子排布式为 ;G元素原子的价电子排布式为 。
(2)元素J与氮元素可以形成化合物NJ3,其中N—J键的化学键类型为 ,根据价层电子对互斥理论可以判断NJ3的空间构型为 ,NJ3分子中N原子的杂化方式为 杂化。
(3)A、J形成的化合物AJ的相对分子质量比A、D形成的化合物AD的相对分子质量小,但AJ的沸点比AD高,其原因是 。
(4)从晶胞图可以得出:E与J形成的离子化合物的化学式为 。
(5)含有E元素的化合物焰色反应为 色,焰色反应的原理是 。
(1)1s22s22p63s23p6(2分) 3d54s2(2分)
(2)共价键(或极性共价键)(1分) 三角锥形(1分) sp3(2分)
(3)前者分子间存在氢键(2分)
(4)CaF2(2分)
(5)砖红(1分)
激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量(2分)
题目分析: A与另外四种元素既不在同一周期,也不在同一主族。判断A是H元素;元素G是周期表中的第7列元素,则G是周期表中第四周期第七副族元素Mn元素;E和G同周期,E的最外层电子数与最内层电子数相同,最内层电子数是2,所以E是Ca元素;E跟J可形成离子化合物,通过计算其晶胞结构中E与J的离子个数比是1:2,则J是-1价非金属;J和D同主族,所以J和D应为F、Cl元素。
(1)Cl元素-1价离子的电子排布式为1s22s22p63s23p6,G是25号Mn元素,其价电子排布式为3d54s2
(2)NF3分子中含有共价键,根据价层电子对互斥理论,中心原子的价层电子对数是4有1对孤对电子,所以空间构型是三角锥型,sp3杂化;
(3)HF分子间存在氢键,使沸点升高;
(4)从晶胞图可以得出:E与J形成的离子个数比为1:2,所以化学式为CaF2
(5)Ca元素的焰色反应是砖红色,焰色反应是因为激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量
