开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的等电子体是 (写一种)。LiBH4中不存在的作用力有___(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_ _____。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是______(填元素符号)。
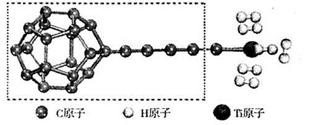
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____种。
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HF 。
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X—定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为 。
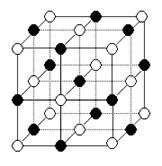
A.87.5% B.92.9% C.96.3% D.100%
(1)①1(1分)②NH4+(1分);C(1分)③H>B>Li(1分)
(2)①<(1分)②Mg(2分)
(3)3 (2分)
(4)H2O分子间氢键数比HF多,所以H2O沸点高(2分);BC (2分) (5)C (2分)
题目分析:(1)①基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,其未成对电子数是1;
②价电子数、原子数分别都相等的是等电子体,则与BH4-互为子体的可以是CH4或NH4+;Li+和BH-4之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键,故选c;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li;
(2)①Li+和H-的电子层结构相同,锂元素的原子序数大于氢元素,所以离子半径Li+<H-;
②根据表中数据可知该元素的第一电离能与第二电离能较小,而该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素;
(3)根据结构图可知,碳元素形成的化学键有碳碳单键、碳碳双键和碳碳三键,因此碳元素的杂化轨道类型有三种即sp1、sp2、sp3杂化。
(4)由于H2O分子间氢键数比HF多,所以H2O沸点高;能形成的氢键的一般是非金属性很强的F、O、N等元素。但氟化氢分子不能通过氢键形成笼状,所以X一定不是甲烷和氟化氢,答案选BC。
(5)根据氯化钠的晶胞可知,表面离子数是26个,而总的离子数是27个,因此这种纳米颗粒的表面粒子数占总粒子数的百分数为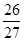 ×100%=96.3%,答案选C。
×100%=96.3%,答案选C。
