钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是 。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式): 。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为 、 。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为 ,每个K+与 个F-配位。
(1)F>B>Mg>K
(2)4s24p1
(3)平面三角形 三角锥形
(4)KMgF3 12
(1)同周期中,随着原子序数的递增,元素电负性增大;同主族中,随着原子序数的递增,元素电负性减小,而且一般情况下,非金属元素的电负性大于金属元素的电负性。
(2)镓为31号元素,位于第四周期,与B同主族,故最外层有3个电子,即价电子排布式为4s24p1。
(3)BF3的中心原子只有3个价电子,与3个F原子提供的3个电子形成3对成键电子,而NF3的中心原子N有5个价电子,与3个F原子提供的3个电子形成3对成键电子,还有1对孤电子对,故前者为平面三角形,后者为三角锥形。
(4)晶胞中的K+为1个,Mg2+为8×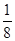 =1个,F-为12×
=1个,F-为12× =3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。
=3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。
