[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为nSnnPn |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个未成对电子; |
⑦H能形成红色(或砖红色)的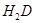 和黑色的HD两种化合物。 和黑色的HD两种化合物。 |
(2)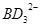 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测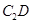 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5)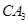 极易溶于
极易溶于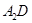 ,原因是 。
,原因是 。
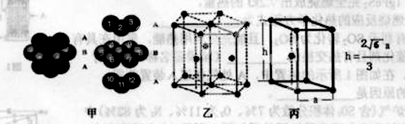
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
若已知E原子半径为r pm,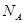 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和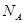 代数式表示)
代数式表示)
(1)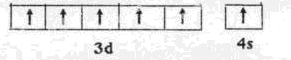 (2分)
(2分)
(2)sp2杂化
(3)直线型
(4)abde
(5)根据“相似相容原理”,极性分子NH3易溶于极性溶剂H2O;NH3分子与H2O分子间可以形成氢键,
(6)六方最密堆积  或
或 
题目分析:由⑦知H是Cu,D是O元素;则A是H元素;B元素原子价电子(外围电子)排布为nSnnPn,则n=2,所以B是C元素;则C是N元素;F元素原子的核外p电子总数比s电子总数多1,有F、Na、Al符合条件,F、Na可排除,则F是Al元素;E的原子半径比F大,但E的第一电离能也比F大,同周期元素中比AL原子半径大的元素又Na、Mg,其中Mg的3s轨道为全满状态,第一电离能比Al大,所以E是Mg元素; G的基态原子核外有6个未成对电子;则G是Cr元素;(1)G元素基态原子的价电子排布式为3d54s1,排布图为 ;
;
(2)根据杂化轨道理论,CO32-中C原子的价层电子对数=3+1/2(4+2-3×2)=3,所以C原子是sp2杂化;
(3)N2O与CO2是等电子体,所以N2O与CO2的空间构型相同,都是直线型分子;
(4)E、F是同周期元素,且F的原子序数小于E。a、E、F的离子的电子层结构相同,核电荷数大的离子半径小,所以离子半径E>F,正确;b、同周期元素核电荷数大的电负性大,所以电负性F>E,正确;c、Mg的原子半径比Al大,所以Al的金属键较强,熔点高,F>E,错误;d、E、F的还原性较强,可以与氧化物发生置换反应,如Mg与二氧化碳的反应,铝热反应,正确;e、E的氧化物氧化铝既能与酸反应,又能与碱反应,具有两性,正确;f、氯化铝是分子晶体,错误,答案选abde;
(5)氨气是极性分子,水也是极性分子,根据“相似相容原理”,极性分子NH3易溶于极性溶剂H2O,且NH3分子与H2O分子间可以形成氢键;
(6)Mg的晶胞结构表示Mg是六方最密堆积;根据“均摊法”计算晶胞中Mg的原子个数是1+1/8×8=2,晶胞的边长a=2r,高h=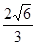 a,1pm=1×10-10cm,
a,1pm=1×10-10cm,
则晶胞的密度=2×24/NA/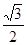 a2h=
a2h=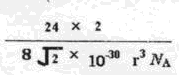 =
=
