A、D、E、X、Y五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,D元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐;X与A同主族;Y元素的最外层电子数是其次外层电子数的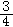 倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
(1)画出Y元素离子的结构示意图__________;写出常温下Y的氢化物与其最高价氧化物对应水化物的浓溶液反应的化学方程式;并用单线桥表示电子转移情况____________。
(2)由A、D、E、Y四种元素形成的强酸的酸式盐的名称为__________,该盐的水溶液中各离子浓度有大到小的顺序为___________。
(3)若1克A的单质燃烧放出的热量为M kJ,试写出表示A单质燃烧热的热化学方程式:___________。
(4)科学家用D、E、X 三种元素形成的化合物XDE3和X2E,在573K时反应制得了离子化合物X3DE4 ;经测定X3DE4中各原子的最外层电子都达到了8电子稳定结构,则DE43-的电子式为__________,X3DE4与二氧化碳或水均能剧烈反应转化为常见物质,写出其中一个反应的化学方程式:_____________。
(1)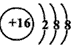 ;H2S+H2SO4(浓)=S↓+SO2↑+2H2O(单线桥“略”)
;H2S+H2SO4(浓)=S↓+SO2↑+2H2O(单线桥“略”)
(2)NH4HSO4 ;c(H+)>c(SO42-)>c(NH4+)>c(OH-)
(3)H2(g)+ O2(g)==H2O(l);△H = -2M kJ/mol
O2(g)==H2O(l);△H = -2M kJ/mol
(4)
Na3NO4+CO2==Na2CO3+NaNO3 或 Na3NO4+H2O==2NaOH+NaNO3
