已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ____________;F离子电子排布式__________。
(2)写出X的化学式__________和化学名称__________。
(3)写出X涉及化工生产中的一个化学方程式__________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:__________。
(5)CE、FA的晶格能分别为786 KJ/mol、3401KJ/mol,试分析导致两者晶格能差异的主要原因是__________。
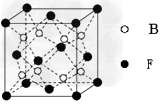
(6)F与B可形成离子化合物,其晶胞结构如图所示: F与B形成离子化合物的化学式为
__________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是__________。(只要求列出算式)。
(1)2s22p4;1s22s22p63s23p6
(2)Na3AlF6;六氟合铝酸钠
(3)2Al2O3(融熔) 2Al+3O2↑
2Al+3O2↑
(4)Al2O3为离子晶体而AlCl3为分子晶体
(5)CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-
(6)CaF2;
