(三选一)【物质结构与性质】
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数:A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M 层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A的简单氢化物分子中中心原子采取____杂化,E的最高价氧化物分子的空间构型是____。
(2)B的氯化物的熔点比D的氯化物的熔点____(填“高” 或“低”),理由是____。
(3)A、B、C、D的第一电离能由小到大的顺序为 ____(用元素符号表示)。
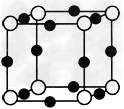
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为__________(每个球均表示1个原子)。
(5)F的价电子轨道表示式是_________,A、C形成的化合物具有高沸点和高硬度的性质,是一种新型无机非金属材料,则其化学式为_________。
(1)sp3;平面三角形
(2)高;NaCl为离子晶体而SiCl4为分子晶体
(3)Na<Al<Si<N
(4)Cu3N
(5)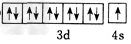 ;AlN
;AlN
