(三选一)【选修3:物质结构与性质】
已知A、B、C、D都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、B原子的L层有2个未成对电子,C的三价阳离子与B的阴离子具有相同的电子层结构。D3+ 3d轨道上电子为半充满状态。请根据以上信息,回答下列问题。
(1)写出B的基态原子的核外电子排布式_________________;D元素在元素周期表中的位置为_________________________。
(2)A的最简单氢化物分子的空间构型是_________________,其中心原子采取_________________杂化,属于___________________(填“极性分子”或“非极性分子”)。
(3)C元素最高价氧化物对应的水化物可用于治疗胃酸过多,写出反应的离子方程式:________________。
(4)H2S和B元素的一种氢化物(分子式为H2B2)的主要物理性质比较如下
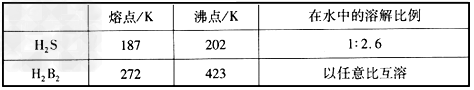
H2S和H2B2的相对分子质量相同,造成上述物理性质差异的主要原因是__________________________。
(5)D和E(质子数为25)两元素的部分电离能数据列于下表
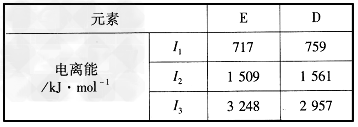
比较两元素的I2、I3可知,气态E2+再失去一个电子比气态D2+再失去一个电子难。对此,你的解释是________________________
(1)4s22s22p4;第四周期第Ⅷ族
(2)正四面体;sp3;非极性分子
(3)Al(OH)3+3H+=Al3++3H2O
(4)熔、沸点差异是因为H2O2分子间存在氢键(或H2S分子间不能形成氢键),溶解性差异是因为H2O2与H2O分子间可形成氢键(或H2S与H2O分子间不能形成氢键)
(5)Mn2+ 3d轨道的电子排布为半充满状态,较稳定
