问题
计算题
在给定温度下发生下述反应:4FeS2(s)+11O2(g)====2Fe2O3(s)+8SO2(g) ΔH="-3" 319 kJ/mol,又知反应后的固体残渣中含有4%的FeS2,试计算燃烧1kg这种硫铁矿时放出的热量。
答案
5674.8 kJ。
设参加反应的FeS2的质量为x,生成Fe2O3是2/3x。
(1-x)=4%(2/3x+1-x),
x="2.88/2.96" kg,
放出的热量=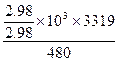 kJ="5674.8" kJ
kJ="5674.8" kJ
