(10分)下图是工业生产硝酸的流程。
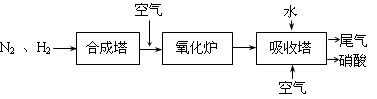
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网。请回答下列问题:
⑴ 1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
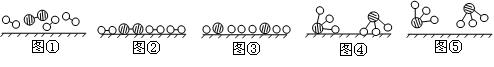
 、
、 、
、 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 。
⑵ 合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g),写出该反应的化学平衡常数表达式K=
2NH3(g),写出该反应的化学平衡常数表达式K=
。在一定温度和压强下,将H2和N2按3∶1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为 。
⑶ 已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.8 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
氨催化氧化的热化学方程式为 。
⑷ 吸收塔中通入空气的目的是 。
⑴ 图②表示N2、H2被吸附在催化剂表面,图③表示在催化剂表面,N2、H2中化学键断裂
⑵ K=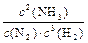 26%
26%
⑶ 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol
⑷ 使NO循环利用,全部转化成HNO3
本题以工业生产HNO3的背景,考查化学基础知识,涉及化学平衡常数,转化率的计算,盖斯定律应用等,属中档题。(2)设N2、H2的物质的量分为a,3a mol,N2的转化率为x。
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始 a 3a 0
平衡 a-x 3a-3x 2x
转化 x 3x 2x
NH3%=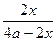 =15%,H2的转化率为:
=15%,H2的转化率为: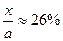 。
。
(3)总反应可由①+②×2求得,H将正负号一并带入计算。
(4)工业生产HNO3为循环反应,为不使N元素损失,故可再通入O2将其反应。
