问题
填空题
(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:
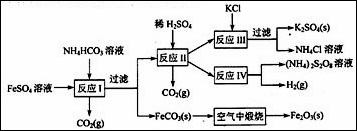
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
A.锌粉
B.铁屑
C.KI溶液
D.H2(2)反应I需控制反应温度低35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是: 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,阳极
发生的电极反应可表示为: 。
答案
(1)B
(2)防止NH4HCO3分解(或减少Fe2+的水解 )
(3)降低K2SO4的溶解度,有利于K2SO4析出
(4)2SO42--2e-=S2O82-
(1)为了防止Fe2+被氧化,所以应加入既能防止Fe2+被氧化,又不会引入新杂质的物质,所以加入铁屑最好。
(2)温度若较高则会促进Fe2+的水解,也会使NH4HCO3分解,所以反应温度应低35℃。
(3)要使K2SO4晶体析出,就要降低其在溶液中的溶解度,由于K2SO4是离子化合物,
在醇类溶剂中的溶解度一定变小。
(4)根据图示知: (NH4)2SO4 (NH4)2S2O8 +H2
(NH4)2S2O8 +H2
H2应在阴极产生,所以阳极发生的变化就为:SO42-→S2O82-
