减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
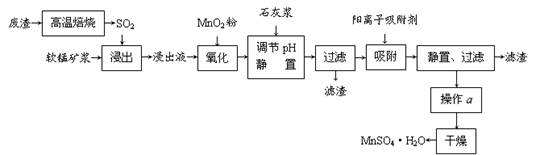
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
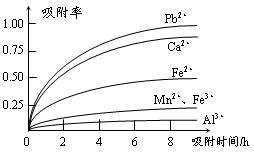
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是 (填写序号)。
a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 等过程。
⑴ SO2+MnO2=MnSO4 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
⑵ 4.7~8.3
⑶ b c d
⑷ 蒸发浓缩结晶
本题以制备硫酸锰的生产流程为知识载体,考查化学反应的书写,及除杂中的问题。(1)从流程图看,浸出过程是软锰矿浆(MnO2)与SO2的反应。杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+。(2)杂质中含有Fe2+、Al3+、Ca2+、Pb2+四种阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂。从吸附率的图可以看出,Ca2+、Pb2+的吸附率较高,故只要调节pH值在4.7~8.3间,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀。(3)结合半径,分析右图知,图中离子从上至下,半径有减小趋势,对应的吸附率减小。随着时间的递增,所有离子的吸附率均增大;另Fe3+和Al3+离子所带电荷数大,其吸附率低。(4)由于制取的MnSO4·H2O含有结晶水,故采用蒸发浓缩结晶的方法。

 架为()
架为()