合成氨工业的部分工艺流程如下图所示:
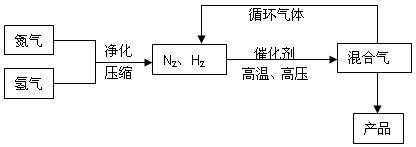
请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g)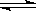 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
A.增大压强
B.降低温度
C.使用催化剂
D.增大反应物的浓度(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示:
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如图)
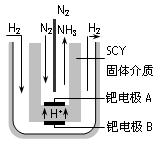
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
(1) -92.4kJ·mol-1
(2) AD
(3)0.04mol/(L·min) 40
(4) 阴 ; N2 + 6e-+6H+= 2NH3
