图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
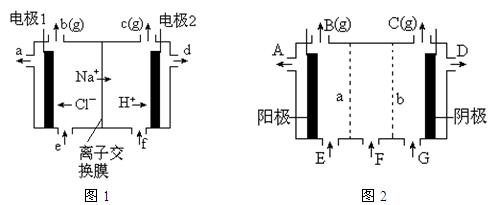
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
⑴、Ca2++CO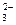 =CaCO3↓ Mg2++2OH-=Mg(OH)2↓
=CaCO3↓ Mg2++2OH-=Mg(OH)2↓
⑵、A C
⑶、B C
⑷、d; Cl2; 正; 增强溶液的导电性,又不影响NaOH纯度。
⑸、①、阴; ②、4OH—4e- ="=" 2H2O + O2↑ ③、NaOH ,H2O(加少量稀硫酸)。
