(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管 。
。
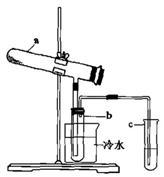
①试管b中得到的主要产物是 ,检验该产物的方法是(结合离子方程式简要说明) 。
②为检验反应的另一种生成物,试管c中应加入的试剂是 ,简述相应的实验现象及结论 。
③所得硫酸的理论浓度(溶质的质量分数)为 。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
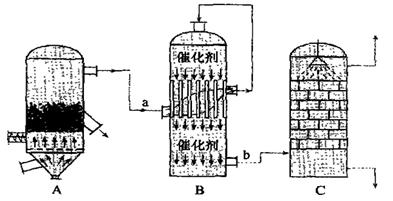
①图中设备A的名称是 ,a、b两处所含气体的化学式分别为 、 。
②有关接触法制硫酸的下列说法中,不正确的是 。
A.二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:①生产成本低、②原料易得、③ 、④
B装置中反应的条件之一为较高温度是为了提高SO2的转化率(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:①生产成本低、②原料易得、③ 、④  、⑤ 、⑥ (可不填满)。
、⑤ 、⑥ (可不填满)。
(1)① H2SO4(1分);Ba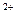 +SO
+SO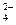 =BaSO4↓(1分)
=BaSO4↓(1分)
取少量溶液于试管中,滴人紫色石蕊试渡,溶液变红色;另取样,滴入BaCl2溶液产生白色沉淀,证明产物是硫酸(2分)
②品红(1分)
生成的气体使品红褪色,并且加热后恢复红色,证明该产物是SO2(2分)
③ 29.5%(2分)
(2)①沸腾炉(1分);SO2、O2、N2(2分);SO3、SO2、O2、N2(2分)
② ABCD(2分)
(3)原料利用率高;硫酸浓度高;对环境污染小;放出热量可以再利用;(共2分。答对1条得1分)
