利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
 N2(g)+3H2(g)
N2(g)+3H2(g) 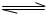 2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H= -483.6kJ/mol
氨气经催化氧化生成一氧化氮气体和水蒸气反应的热化学方程式为 。
(2)在容积固定的密闭容器中发生上述氨气的催化氧化反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.54 | 0.9 | 0.56 |
②反应在第2min到第4min时O2的平均反应速率为 ;
③反应在第2min改变了反应条件,改变的条件可能是 或
④若反应在第6min后仅改变一种反应条件。所改变的条件和判断的理由是
。
(1)4NH3(g)+5O2(g) 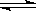 4NO(g)+6H2O (g);ΔH=-905kJ·mol—1 (3分)
4NO(g)+6H2O (g);ΔH=-905kJ·mol—1 (3分)
(2)①可增大NH3的转化率(2分) ②0.1875 mol/(L·min) (2分)
③使用催化剂(2分) 升高温度(2分)
④增加NH3的浓度,(2分)
因为6min后平衡向正反应方向移动,而NH3的浓度又增大了。(1分)
