抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:

已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1molFeS2放出热量为853kJ,则FeS2燃烧的热化学方程式为_____________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为_____________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_____________(任写一个)。
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________。
(3)硫酸生产中炉气转化反应为:2SO2(g)+ O2(g)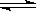 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
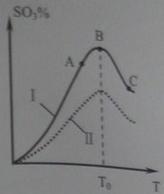
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是: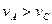
C.反应达到B点时,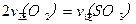
D.已知V2O5的催化效果比Fe2O3好,若Ⅰ表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
(1)4FeS2(S)+11O2(g)=8SO2(g)+2Fe2O3(s) ,△H= -3412 kJ ·mol -1
(2)SO2+ Na2CO3=Na2SO3+CO2↑
2 SO2+ Na2CO3+H2O=NaHSO3+CO2↑ (写对任意一个均给分)
(3)Fe3++3OH- = Fe(OH)3↓或Fe2++2OH- = Fe(OH)2↓
或Mg2++2OH- = Mg(OH)2↓或HSO3-+ OH-= SO32- + H2O
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC
