(12分)MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下:
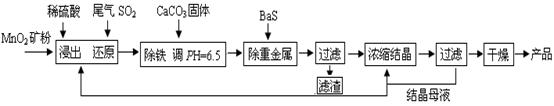
已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 ▲ 。
(2)除铁发生的离子反应方程式为 ▲ 。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= ▲ mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解 的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 ▲ 时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= ▲ 时锰、铬去除率最好
(共12分)(1)增大反应物接触面积,加快反应速率; (2分)
(2)2Fe3+ + 3H2O + 3CaCO3 = 2Fe(OH)3↓+ 3CO2↑+ 3Ca2+ (2分)
(或 Fe3+ + 3H2O = Fe(OH)3↓+ 3H+ 2H+ + CaCO3 = Ca2+ + CO2↑+ H2O )
(3)6.3×10-31 (2分) (二)3MnS O4·H2O
O4·H2O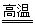 Mn3O4 + SO2↑+ 2SO3↑+ 3H2O (2分)
Mn3O4 + SO2↑+ 2SO3↑+ 3H2O (2分)
(三)15% (2分) 4 (2分)
