(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
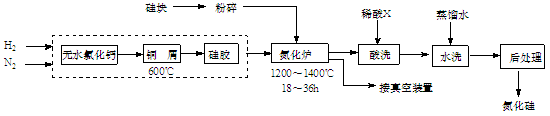
(1)净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;体系中要通入适量的氢气是为了 。
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
(1)除去原料气中的氧气(2分);除去生成的水蒸气(2分)。
(2)这是放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触(2分);
将体系中的氧气转化为水蒸气,而易被除去(若答将整个体系中空气排尽也可得分)(2分)。
(3)硝酸(2分) (4)9Si+4NaN3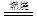 3Si3N4 +4Na↑(2分)
3Si3N4 +4Na↑(2分)
(1)由于氧气和水蒸气都能腐蚀氮化硅,而氮气和氢气中含有水蒸气和氧气,所以铜屑的作用是除去氧气,硅胶是除去水蒸气的。
(2)因为这是放热反应,如果温度过高,局部过热,会导致硅熔化熔合成团,阻碍与N2的接触;通入氢气能将体系中的氧气转化为水蒸气,而易被除去。
(3)由于关于硅中含有铜的氧化物,在反应中氧化铜能被还原生成铜,因此要除去铜应该选择硝酸,盐酸和硫酸不能溶解铜,氢氟酸能腐蚀氮化硅。
(4)由于是置换反应,所以另一种生成物是钠,方程式未9Si+4NaN3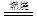 3Si3N4 +4Na↑。
3Si3N4 +4Na↑。
