下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
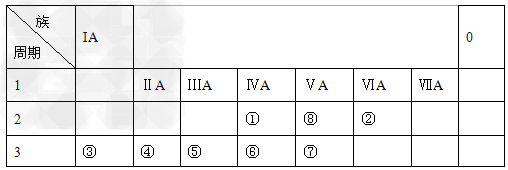
(1)②、④、⑤的原子半径由大到小的顺序为____________________。 ②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3)②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是______________(填名称),用原子结构知识解释____________,可以验证该结论的实验是________(填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为____________________,
(1)Mg Al O;O2- Mg2+ Al3+
(2)H2O;SiH4
(3)2:1
(4)Al(OH)3+OH-=[Al(OH)4]-
(5)C+SiO2 2CO↑+Si
2CO↑+Si
(6)镁;镁原子半径比铝原子半径大,原子核对外层电子吸引能力较弱,失电子能力较强;bcd
(7)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
