(16分)学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会遇到各种各样的化学反应。
(1) 明矾[KAl(SO4)2]是一种盐。其在水中的电离方程式是 ,明矾的用途是 。
(2)微粒32X2- 核外有18个电子,则它的核电荷数为 ,核内中子数为 。
(3)工业上用铝粉还原一些金属氧化物,这类反应称为铝热反应。写出在高温下铝还原氧化铁的化学方程式_______________________________________,在反应中消耗2mol铝,则转移了_________mol电子
(4)用氢氧化铝治疗胃酸过多的离子方程式:
(5)工业生产漂白粉的化学方程式
(1)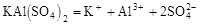 ,净水剂;
,净水剂;
高温 |
 2Fe+Al2O3, 6;
2Fe+Al2O3, 6;(4)Al(OH)3+3H+ Al3+ +3H2O
Al3+ +3H2O
(5)2Cl2+2Ca (OH)2 ="==" CaCl2+Ca(ClO)2+2H2O
题目分析:(1)明矾是一种复盐,是强电解质,应完全电离,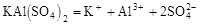 ;其用途是利用铝离子水解生成氢氧化铝胶体对自来水进行净水,作净水剂;(2)由微粒32X2- 形式可知其是由原子得2个电子后核外有18个电子的,所以原子时电子为16,则其质子数和核电荷数为16,由质量数32可求中子数为32-16=16;(3)铝热反应特点是得到铝的氧化物和其他金属的单质,根据2个Al反应转移6个电子,可知消耗2mol铝,则转移了6mol电子;(4)胃酸的主要成分为盐酸,注意Al(OH)3难溶不能拆成离子形式;(5)工业制漂白粉用Cl2和石灰乳反应。
;其用途是利用铝离子水解生成氢氧化铝胶体对自来水进行净水,作净水剂;(2)由微粒32X2- 形式可知其是由原子得2个电子后核外有18个电子的,所以原子时电子为16,则其质子数和核电荷数为16,由质量数32可求中子数为32-16=16;(3)铝热反应特点是得到铝的氧化物和其他金属的单质,根据2个Al反应转移6个电子,可知消耗2mol铝,则转移了6mol电子;(4)胃酸的主要成分为盐酸,注意Al(OH)3难溶不能拆成离子形式;(5)工业制漂白粉用Cl2和石灰乳反应。
点评:书写电离方程式注意是否完全电离,理解原子的表示符号各位置表示的含义,熟悉铝热反应特点,熟悉常见的化学反应
