下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | d | g | l | |||||||||||||
(2)请写出e元素的原子电子轨道表示式______;
(3)ya3分子的电子式是______,其分子的空间构型是______,
(4)b、e两种元素中,金属性较强的是______;第一电离能大的是______.(填元素符号)
(5)h的i形成hi2分子杂化类型是______ fh32-的空间构型分别为______.
(1)由元素在周期表中的位置可知,d为Fe元素,原子序数为26,则Fe3+的核外电子排布式的1s222s2p63s23p63d5,故答案为:1s222s2p63s23p63d5;
(2)e为Al元素,原子序数为13,其电子轨道表示式为
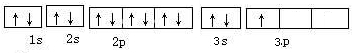
,
故答案为:

;
(3)y为N,a为H,则ya3分子为NH3,其电子式为
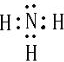
,空间构型为三角锥形,故答案为:
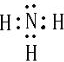
;三角锥形;
(4)b为Mg,e为Al,金属性Mg>Al,镁原子最外层为全满,失去1个电子较难,则第一电离能大,故答案为:Mg;Mg;
(5)h为O,i为F,f为C,OF2分子中O原子上有2对孤电子对,σ键数为2,则杂化类型sp3,CO32-中无孤电子对,σ键数为3,则杂化类型sp2,则空间构型为平面正三角形,
故答案为:sp3;平面正三角形.
