KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2,另含Al2O3、SiO2杂质)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
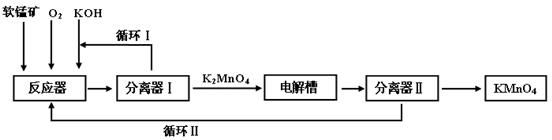
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿会导致KOH消耗量偏高,用离子方程式表示KOH消耗偏高的原因 、
。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式:
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
与传统法相比,液相法的优点是:__ _________。
(11分)(1)4KOH+2MnO2+O2=2K2MnO4+2H2O(2分)
(2)2OH—+Al2O3=2AlO2—+H2O 2OH—+SiO2= SiO 32—+H2O(2分)
(3)阴极:2H2O+2e— = H2↑+2 OH—(1分)(写成2H++2e—=H2↑也给分)
阳极:2MnO42—-2e—=2MnO4—(1分) KOH(1分)
(4)3 K2MnO4+ 2CO2= 2 KMnO4+ 1 MnO2+ 2 K2CO3(1分) 产率高(1分)
