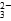问题
选择题
下列性质的比较,错误的是( )
A.稳定性:HI<HBr<HCl<HF
B.酸性:H2SiO3<H3PO4<H2SO4<HClO4
C.原子半径:O<F<Na<Mg
D.最高正化合价:Si<P<S<Cl
答案
A.同主族元素从上到下元素的非金属性逐渐降低,则非金属性:F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HI<HBr<HCl<HF,故A正确;
B.同周期元素从左到右元素的非金属性之间增强,则非金属性:Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H2SiO3<H3PO4<H2SO4<HClO4,故B正确;
C.同周期元素从左到右原子半径逐渐减小,则原子半径:O>F;Na>Mg,原子核外电子层数越多,半径越大,则原子半径:Na>Mg>O>F,故C错误;
D.Si、P、S、Cl的最外层电子数分别为4、5、6、7,则最高化合价以此为+4、+5、+6、+7,故D正确.
故选C.

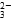 +H2O
+H2O +5NO
+5NO +6H+=2Mn2++5NO
+6H+=2Mn2++5NO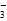 +3H2O
+3H2O