下表是元素周期表的一部分,请回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)⑤元素与⑧元素形成化合物的电子式是______
(3)③⑦⑧三种元素原子半径由小到大的顺序是______
(4)将⑤⑥两种单质用导线相连后,同时浸入稀硫酸中,⑥这一极发生______(填“氧化”或“还原”)反应.
根据元素在周期表中的分布知识,可以推知①为C,②为N,③为F,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Ar.
(1)同周期元素的原子,从左到右非金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱,同主族元素的原子,从下到上非金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱所以非金属性最强的元素在右上角,即为F,碱性最强的在左下角,为NaOH,氢氧化钠是含有离子键和共价键的共价化合物,故答案为:F;NaOH;离子键、共价键;
(2)氯化镁是氯离子和镁离子之间通过离子键形成的离子化合物,电子式为:
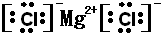
,
故答案为:
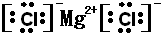
;
(3)电子层越多半径越大,所以F的半径最小,电子层一样多时,核电荷数越多半径越小,所以Cl<S,故答案为:F<Cl<S;
(4)⑤为Mg,⑥为Al,镁、铝、硫酸构成的原电池,金属铝做正极,发生还原反应,故答案为:还原.