(12分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
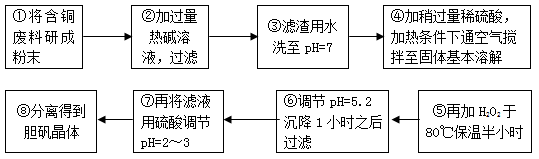
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
(1)步骤①中为什么要将含铜废料研磨成粉状?
 。
。
(2)步骤⑤中H2O2参加反应的离子方程式:  。
。
(3)步骤⑥中调节溶液pH时适宜的物质是 。(填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣成份的化学式 。
(4)步骤⑦中用硫酸调节pH=2~3的原因是 。
(5)步骤⑧的分离操作是: , 冷却结晶, 。
(12分)(1)增大固体反应物的表面积,增大化学反应的速率。
(2) 2Fe2++H2O2 +2H+=2Fe3++2H2O 。
(3)C、D ; Fe(OH)3 。
(4)加热蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质。 蒸发浓缩, 过滤。

 托确定和记录患者面下1/3的适宜高度
托确定和记录患者面下1/3的适宜高度