(选修—化学与技术)(15分)
(1)工业上以粗铜为原料采取如图1所示流程制备硝酸铜晶体:
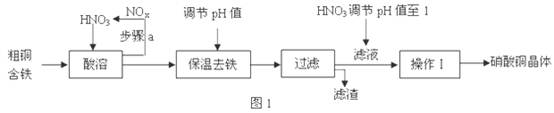
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,根据下表数据,溶液的pH值应保持在 范围。调节pH值时,可以向溶液中加入的试剂是( )
(a) NaOH溶液 (b) 氨水 (c) Cu(OH)2 (d) CuO
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
④从滤液中制取硝酸铜晶体的操作Ⅰ的具体步骤是 。
(2)图2是某小组学生查阅资料后所绘出的硝酸铜晶体[Cu(NO3)2 nH2O]的溶解度曲线(温度在300C左右对应不同的晶体),下列说法正确的是( )
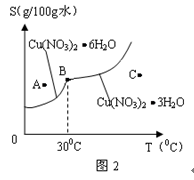
(a) A点时的溶液为不饱和溶液
(b) B点时两种晶体可以共存
(c)按上述流程最终得到的晶体一定是Cu(NO3)2 3H2O
(d) 若将C点时的溶液降温至300C以下,可以析出Cu(NO3)2 6H2O晶体
(15分)
(1)①将NOx转化为硝酸,提高原料的利用率,减少污染物的排放。(3分)
②3.2——4.7 (2分) (c 、d) (2分)
③由于铜离子水解:Cu2++ 2H2OCu(OH)2 +2H+,加入HNO3能抑制硝酸铜水解(3分)
④蒸发浓缩、冷却结晶、过滤洗涤(3分)
(2)b、d(2分)
(1)①氮的氧化物与氧气和水反应生成硝酸,可以循环使用,减少大气污染,所以通入氧气和水的作用是将NOx转化为硝酸,提高原料的利用率,减少污染物的排放。
②根据氢氧化铁完全沉淀时的PH和氢氧化铜开始沉淀时的PH可以确定溶液的PH应该在3.2——4.7之间。调节pH值时,可以向溶液中加入的试剂是氢氧化铜和氧化铜,若加入氢氧化钠和氨水则铜离子也会被沉淀。
③操作1是蒸发结晶,而铜离子在水中会发生水解产生氢氧化铜调节PH为酸性可以抑制水解,离子方程式为 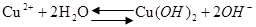
④操作Ⅰ是蒸发结晶,操作步骤为蒸发浓缩、冷却结晶、过滤洗涤。
(2)A点在溶解度曲线之上所以A点是饱和溶液; B点是两种晶体的共存状态,蒸发结晶得到晶体不一定是Cu(NO3)2 3H2O ;根据溶解度曲线可以得出降温至300C以下,可以析出Cu(NO3)2 6H2O晶体。所以选b、d。
